机构简介
一、临床试验开始前流程
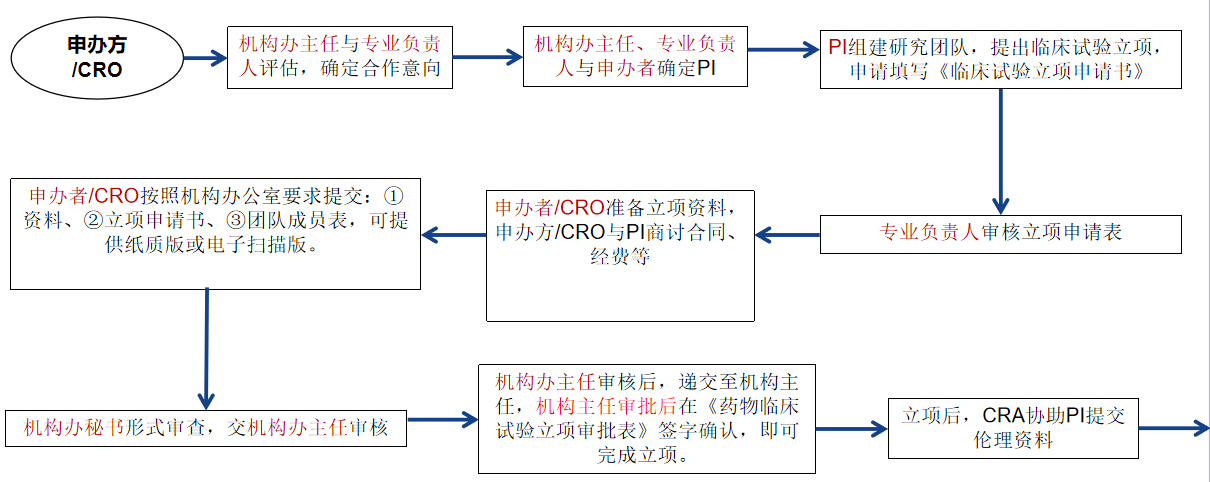

二、具体工作流程
为提高工作效率,保证药物临床试验质量,本机构办公室规定如下,请各申办方、CRO、各单位CRA、CRC及研究者配合我们的工作,将按以下流程执行。
1.申办方应邀请研究者和机构办公室参加多中心方案讨论会/研究者会,根据我院实际对试验方案设计等进行沟通交流。
2.申请新临床试验项目的具体流程:根据要求将项目电子版的资料(项目立项必需资料为研究者手册、试验方案、病例报告表样表、知情同意书、国家局临床试验批件/受理通知函、临床前实验室资料以及试验药物药检证明,其他资料及更新版文件请在立项后及时补充和更新)发送至我院GCP办公室邮箱:fysfcyygcpjgb@163.com,所有上传文件均需有申办方盖章!!!发送资料前后均无需来电告知。机构办公室会根据发送的电子资料与专业组项目负责人进行沟通,确定新项目是否承接,并在随后邮件中反馈。
3.邮件回复同意立项后,请您根据《药物临床试验立项资料目录》所需材料整理,并以电子版形式发送至GCP办公室邮箱。邮件主题请注明“项目名称-立项审核电子材料-日期”,以便我们准确识别和处理。邮件发送成功后,我们将及时回复“收到”,表示文件已成功接收。机构办秘书将在收到电子材料后的3个工作日内完成初步审核,并通过邮件向您反馈审核意见。若材料存在缺失或需要补充,请您根据反馈意见及时修改并重新提交。
注释:文件为受控文件,请勿随意修改。完整的纸质材料请在启动会前至少3个工作日递交至机构质量管理员(资料清单详见药物临床试验立项资料目录)。
并将签好字的申请表,送交至机构办公室,待机构主任签字审核确认后,即为项目成功立项。立项申请表需递交两份签字原件,一份领取走,一份由机构办保存。
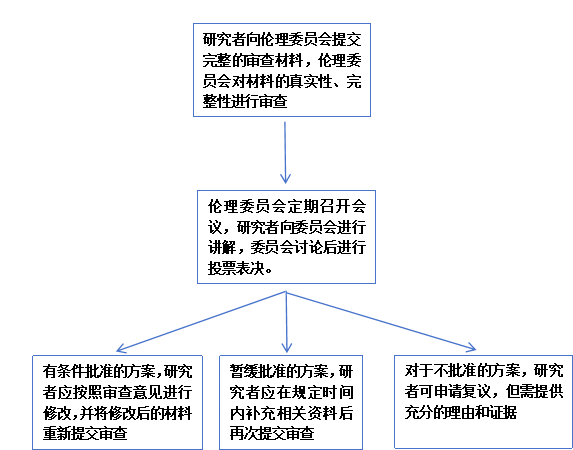
伦理审查:
临床试验立项申请经机构审核同意后,本机构伦理委员会对临床试验项目进行伦理审查,并形成书面审查记录和伦理审查批件。请与伦理联系并上交材料审查。
签订合同:
伦理委员会受理后,申办方/CRO即可拟定合同,签字后交给PI签字,再交至机构质量管理员(或机构办秘书)进行合同条款的审核,条款初步审核后交由机构办主任审核,再交至机构主任审核签署合同。
启动会:
启动会前准备:合同协议签署后,申办者/CRO准备试验资料、药物、物资等。资料交至机构办公室、药物及物资交至GCP药房,做好交接记录,申办者代表确认《项目启动信息表》,确定会议时间、地点、会议流程、参加人员及其它相关事宜,填写《临床试验项目启动审核表》申办者代表/PI将《项目启动信息表》、《临床试验项目启动审核表》递交机构办公室秘书,并告知启动会议准备的相关信息,机构质量管理员对项目启动信息表内容进行复核后,机构办公室主任进行审核,安排机构及相关科室人员参加项目启动会及项目启动培训。
启动会流程:
1、PI进行研究分工授权。保证各岗位人员各司其职,熟悉流程。
2、机构办公室主任(或专业组负责人/主要研究者等)对研究人员进行GCP主要内容及临床试验简要流程的培训。
3、申办者和(或)CRO指定的人员对研究人员进行临床试验方案(以PPT方式)、入排标准及与试验相关内容的培训。
4、机构办质量管理员、药物管理员与申办者和(或)CRO指定的人员模拟及熟悉药物发放、回收流程,完善药物发放回收记录表,以确保临床试验有序进行。
1. 药物接收流程

2. 伦理审查流程
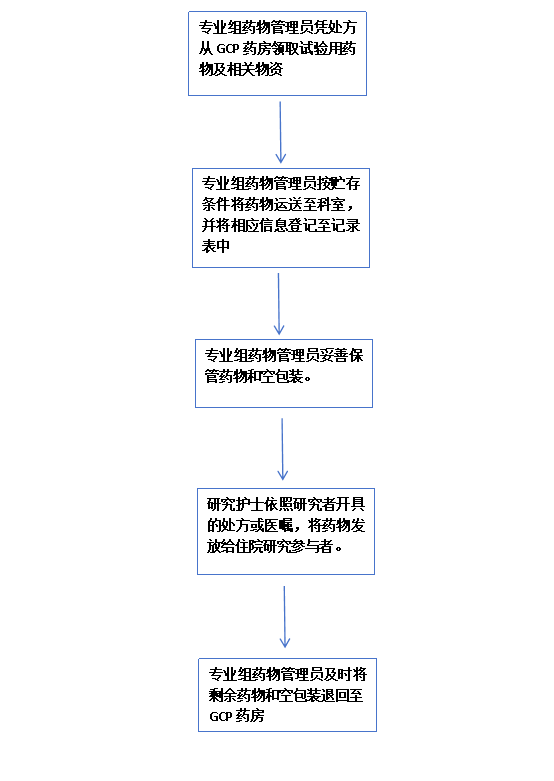
3. 药物发放流程
医生下医嘱后,专业组药物管理员凭处方从GCP药房领取试验用药物试验用相关物资。专业组药物管理员按贮存条件将药物运送至科室,记录运送工具、到科时间/温度,登记至《临床试验药物运送过程温度记录表》。专业组药物管理员应妥善保管包装盒及剩余药物,并将包装盒及剩余药物及时归还给GCP药房。研究护士发放试验用药物时,将研究参与者基本信息包括物资名称、物资编码、研究参与者鉴认代码、发放日期、发放数量等内容登记至《临床试验用药物发放记录表》,并签名。
4. 临床试验结束后资料归档和结题
4.1 机构药物管理员将药物管理记录交给机构资料档案管理员。
4.2 临床试验结束后,专业组资料管理员将临床试验资料收集、检查、整理后交机构资料档案管理员验收、复审、记录,交接双方填写《药物临床试验资料交接清单》(样表)签名并签署日期。
4.3 专业自查质控和机构结题质控后,专业资料管理员,对临床试验的项目资料进行整理、检查,填写归档目录表及临床试验项目备案表。
4.4 PI向机构办公室递交临床试验结题表、向伦理委员会提交伦理审查结题。
4.5 机构在收到结题报告后,及时组织机构质量管理员对项目进行锁库前质控。
4.6 机构资料管理员根据实际归档资料清单填写归档记录表。
4.7 CRA将CRF原件交统计单位进行数据录入和盲态核查,研究者负责回答及填写统计单位的质疑表。
4.8 PI和(或)专业负责人(或)和机构办公室主任参加临床试验项目总结会议。机构办主任审核结题报告,签字。
上述涉及到的文件等相关资料,请联系药物临床试验机构办公室,我们将及时为您提供所需的电子版资料。















